Zgodnie ze sposobem łączenia aminokwasu i cukru, peptyd cukrowy można podzielić na cztery kategorie: glikozylacja O, glikozylacja C a N, scukrzanie rosy i połączenie GPI (glikofosfatydyinozytol).
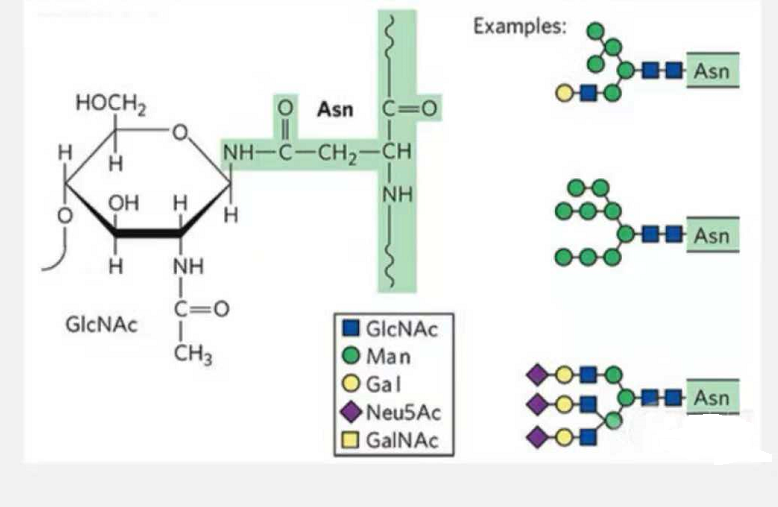
1. Glikopeptydy N-glikozylacyjne składają się z N-acetamidu glukozy na redukującym końcu łańcucha glikanu (Glc-Nac) połączonego z atomem N w grupie amidowej łańcucha bocznego pewnego Asn w łańcuchu peptydowym oraz Asn zdolne do połączenia łańcucha glikanu muszą znajdować się w AsN-X-Ser /Thr (X! =P) w motywie utworzonym przez reszty.Cukier to N-acetyloglukozamina.
Glikopeptyd strukturalny modyfikowany N-glikozylacją
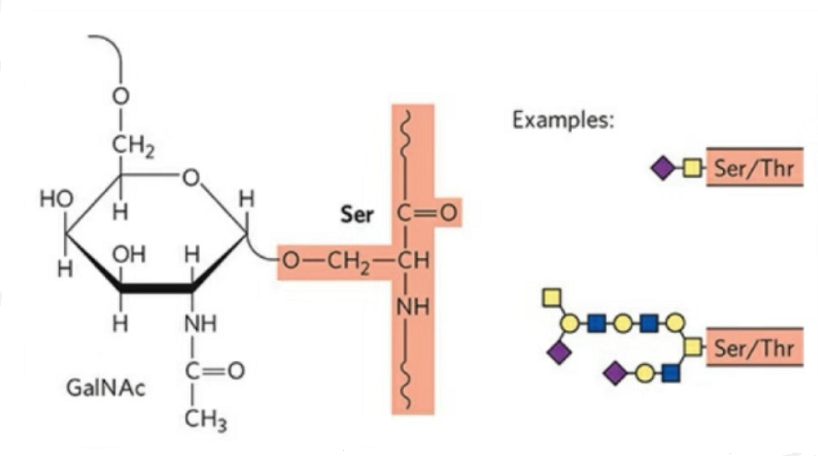
2. Struktura O-glikozylacji jest prostsza niż N-glikozylacji.Ten glikopeptyd jest na ogół krótszy niż glikan, ale ma więcej typów niż N-glikozylacja.Ser i Thr ogólnie mogą być glikozylowane w łańcuchu peptydowym.Ponadto istnieją glikopeptydy ozdobione glikozylacją tyrozyny, hydroksylu i hydroksyproliny.Pozycją łącznika jest atom tlenu hydroksylu w łańcuchu bocznym reszty.Połączonymi cukrami są galaktoza lub N-acetylogalaktozamina (Gal&GalNAc) lub glukoza/glukozamina (Glc/GlcNAc), mannoza/mannozamina (Man/ManNAc) itp.
O-glikozylacja modyfikuje strukturę
3. Glikozylacja glikopeptydu O-GlcNAC ((N-acetylocysteina (NAC)) (glcnAcN-acetyloglukozamina/acetyloglukozamina)
Pojedyncza glikozylacja N-acetyloglukozaminy (GlcNAc) łączy białka O-GlcNAc z hydroksylowym atomem tlenu reszty seryny lub treoniny białka.Glikozylacja O-GlcNA to monosacharydowa ozdoba O-GlcNAc bez przedłużenia glikanu;Podobnie jak fosforylacja peptydów, glikozylacja glikopeptydów O-GlcNAc jest również dynamicznym procesem dekoracji białek.Nieprawidłowa dekoracja O-GlcNAc może powodować różne choroby, takie jak cukrzyca, choroby sercowo-naczyniowe, nowotwory, choroba Alzheimera i tak dalej.
Punkty glikozylacji glikopeptydów
Podstawowe struktury łańcuchów polipeptydowych i cukrowych są połączone z łańcuchami białkowymi wiązaniami kowalencyjnymi, a miejsca łączące łańcuchy cukrowe nazywane są miejscami glikozylacji.Ponieważ nie ma szablonu umożliwiającego śledzenie biosyntezy łańcuchów cukrowych glikopeptydów, różne łańcuchy cukrowe zostaną przyłączone do tego samego miejsca glikozylacji, co prowadzi do tak zwanej mikroskopijnej niejednorodności.
Glikozylacja glikopeptydów
1. Wpływ glikozylacji glikopeptydów na skuteczność terapii białkami terapeutycznymi
W przypadku białek terapeutyczno-terapeutycznych glikozylacja wpływa również na okres półtrwania i celowanie leków białkowych in vivo
2. Glikozylacja rozpuszczalnych glikopeptydów i białek
Badania wykazały, że łańcuchy cukrowe na powierzchni białek mogą poprawiać rozpuszczalność molekularną białek
3. Glikozylacja glikopeptydów i immunogenność białek
Z jednej strony łańcuchy cukrowe na powierzchni białek mogą indukować specyficzną odpowiedź immunologiczną.Z drugiej strony łańcuchy cukrowe mogą pokrywać pewne powierzchnie na powierzchni białka i zmniejszać jego immunogenność
4. Glikozylacja glikopeptydów zwiększająca stabilność białka
Glikozylacja może zwiększyć stabilność białek w różnych warunkach denaturacji (takich jak denaturaty, ciepło itp.) i uniknąć agregacji białek.Jednocześnie łańcuchy cukrowe na powierzchni białek mogą również pokrywać niektóre punkty degradacji proteolitycznej cząsteczek białka, zwiększając w ten sposób odporność białek na proteinazy
5. Glikozylacja glikopeptydów wpływająca na aktywność biologiczną cząsteczek białek
Zmiana glikozylacji białek może również umożliwić cząsteczkom białek tworzenie nowych aktywności biologicznych
Czas publikacji: 03 sierpnia 2023 r