Tło
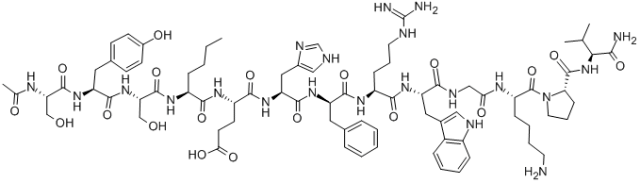
Melanotan I, znany również jako afamelanotyd, to liniowy polipeptyd złożony z 13 aminokwasów, który może odgrywać coraz większą rolę w badaniach farmaceutycznych. Podstawowe angielskie nazwy Melanotanu I to Melanotan-1 i Afamelanotide. Jako syntetyczny analog hormonu stymulującego α-melanocyty α-MSH), Melanotan I może być stosowany w leczeniu zaburzeń nadwrażliwości na światło wywołanych protoporfirią erytropoetyczną. Obecnie większość produktów Melanotan I jest oznaczona wyłącznie do celów badawczych i nie jest jeszcze przeznaczona do stosowania u ludzi. W tradycyjnej syntezie w fazie stałej wybór żywicy znacząco wpływa na skuteczność sprzęgania i końcową czystość produktu.
Podstawowe informacje
Chińska nazwa: Melanotan 1
Nazwa angielska: Melanotan-1
Nr firmy: GT-A006
Nr CAS: 75921-69-6
Sekwencja: SYS{Ne}EH{D-Phe}RWGKPV-NH2
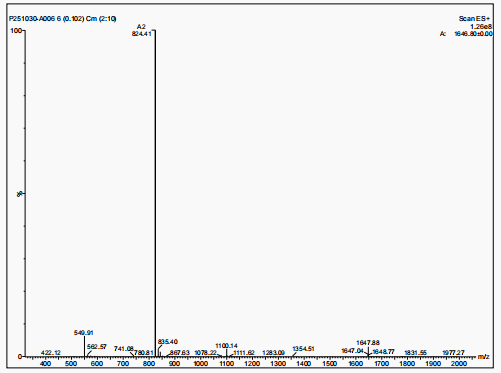
Wzór cząsteczkowy: C78H111N21O19
Masa cząsteczkowa: 1646,88
Metoda przygotowania
I. Przygotowanie żywicy Fmoc-Val-Amino
Krok 1:Odważ 11,11 g (5 mmol) żywicy Ramage Amide AM o stopniu podstawienia 0,45 mmol/g i dodaj ją do reaktora w fazie stałej. Dodaj DCM, aby spęcznić żywicę przez 30 minut, następnie odcedź. Przemyć trzykrotnie DMF. Dodać roztwór DMF zawierający 20% piperydyny (v/v) i reagować przez 5 minut. Dodać kolejny 20% roztwór piperydyny DMF i reagować przez 10 minut, z jednym przemyciem DMF pomiędzy nimi. Po zakończeniu reakcji odcedzić i przemyć trzykrotnie DMF.
Krok 2:Rozpuścić 5,09 g Fmoc-Val-OH, 2,02 g HOBT (1-hydroksybenzotriazol) i 2,32 ml DIC (N,N'-diizopropylokarbodiimidu) w DMF w temperaturze 0°C. Po całkowitym rozpuszczeniu dodać mieszaninę do kolumny reakcyjnej i reagować w temperaturze pokojowej przez 1 godzinę. Postęp reakcji należy monitorować za pomocą testu ninhydrynowego, upewniając się, że wynik jest negatywny. Po zakończeniu reakcji przemyć trzykrotnie DMF w celu otrzymania żywicy Fmoc-Val-amino.
II. Przygotowanie w pełni chronionego peptydu żywicy melanotanu I.
Krok 1:Dodać 20% piperydyny w roztworze DMF (stosunek objętościowy) do powyższej Fmoc-Val-aminożywicy. Reagować przez 5 minut, następnie dodać kolejną porcję 20% piperydyny w roztworze DMF i reagować przez 10 minut. W przerwie przemyć raz DMF. Po zakończeniu reakcji wysuszyć pod próżnią i przemyć trzykrotnie DMF.
Krok 2:Rozpuścić 5,06 g Fmoc-Pro-OH, 2,02 g HOBT (1-hydroksybenzotriazol) i 2,32 ml DIC (N,N'-diizopropylokarbodiimidu) w DMF w temperaturze 0°C. Po całkowitym rozpuszczeniu dodać mieszaninę do kolumny reakcyjnej i reagować w temperaturze pokojowej przez 1 godzinę. Postęp reakcji monitorować za pomocą testu ninhydrynowego (test Kaisera) do czasu uzyskania wyniku ujemnego. Po zakończeniu przemyć trzykrotnie DMF w celu otrzymania Fmoc-Pro-Val-aminożywicy.
Krok 3:Postępując zgodnie z metodą opisaną w Kroku 2, sprzęgaj kolejno każdy aminokwas zgodnie z sekwencją Melanotanu I. Po zakończeniu reakcji sprzęgania Ac-Ser(tBu)-OH przemyj trzy razy DMF, trzy razy DCM (dichlorometan) i trzy razy metanolem. Wysuszyć pod próżnią, aby otrzymać 23,89 g w pełni zabezpieczonego peptydu związanego z żywicą Melanotan I.
III. Przygotowanie surowego peptydu melanotanu I
23,89 g w pełni zabezpieczonego peptydu związanego z żywicą Melanotan I umieszczono w kolbie okrągłodennej. W temperaturze 0°C powoli dodano, mieszając, 250 ml wcześniej przygotowanego koktajlu rozszczepiającego (składającego się z TFA:tioanizolu:fenolu:triizopropylosilanu:wody = 82,5:7,5:5:3:2 objętościowo). Mieszaninę poddano reakcji w niskiej temperaturze przez 0,5 godziny, a następnie reakcję w temperaturze pokojowej przez 2 godziny. Roztwór rozszczepiający następnie przesączono pod próżnią. Roztwór ten powoli dodano do 2 l lodowatego bezwodnego eteru dietylowego, mieszając. Surowy peptyd wyizolowano przez filtrację, przemyto trzykrotnie lodowatym eterem dietylowym i otrzymano 8,55 g surowego peptydu Melanotan I.
IV. Przygotowanie oczyszczonego peptydu melanotanu I
Krok 1:Rozpuścić surowy peptyd Melanotan I w 100 ml oczyszczonej wody i przesączyć przez membranę 0,45 µm w celu otrzymania surowego roztworu peptydu.
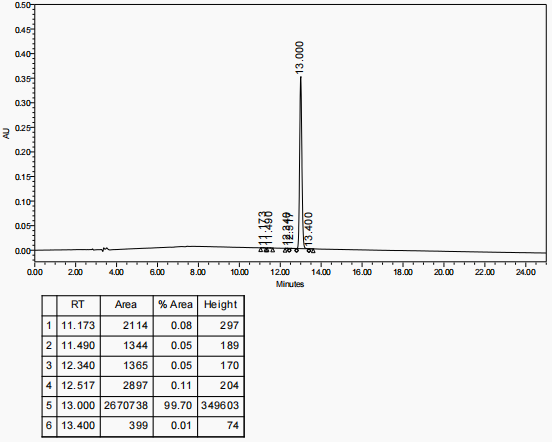
Krok 2:Oczyścić surowy peptyd Melanotan I za pomocą wysokosprawnej chromatografii cieczowej (HPLC). Wykorzystać kolumnę dynamiczną z kompresją osiową DAC-HB50 z fazą ruchomą A (0,05% wodny roztwór kwasu trifluorooctowego) i fazą ruchomą B (0,05% kwas trifluorooctowy w acetonitrylu). Przeprowadzić elucję gradientową w celu rozdzielenia i oczyszczenia. Wykryj próbkę za pomocą detektora UV i zbierz roztwór peptydu odpowiadający pikowi docelowemu we frakcjach.
Krok 3:Po oczyszczeniu HPLC otrzymać 180 ml roztworu trifluorooctanu Melanotanu I o czystości przekraczającej 99%. Zatężyć roztwór do 50 ml na wyparce obrotowej.
Krok 4:Zrównoważyć kolumnę chromatograficzną wodą dejonizowaną i załadować 50 ml oczyszczonego roztworu trifluorooctanu Melanotanu I (czystość > 99%). Eluować przez 50 minut w układzie 2% wodnego roztworu kwasu octowego. Zatężyć zebrany produkt docelowy do 80 ml na wyparce obrotowej. Przeprowadzić wstępne suszenie sublimacyjne i liofilizację, aby ostatecznie otrzymać 5,33 g oczyszczonego peptydu Melanotan I, z wydajnością 32,33%.
Czas publikacji: 2026-01-05
