Peptydy są klasą związków utworzonych przez połączenie wielu aminokwasów przez wiązania peptydowe. Są wszechobecni w żywych organizmach. Do tej pory w organizmach żywych znaleziono dziesiątki tysięcy peptydów. Peptydy odgrywają ważną rolę w regulacji działań funkcjonalnych różnych systemów, narządów, tkanek i komórek oraz w aktywności życiowej, i są często stosowane w analizie funkcjonalnej, badaniach przeciwciał, opracowywaniu leków i innych dziedzin. Wraz z opracowaniem technologii biotechnologii i syntezy peptydów opracowano i stosowano coraz więcej leków peptydowych w klinice.
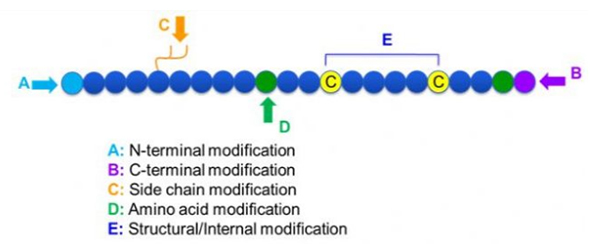
Istnieje wiele różnych modyfikacji peptydów, które można po prostu podzielić na modyfikację po modyfikacji i modyfikacji procesu (przy użyciu modyfikacji aminokwasu pochodnej) oraz modyfikacji N-końcowej, modyfikacji C-końcowej, modyfikacji łańcucha bocznego, modyfikacji aminokwasów, modyfikacji szkieletu itp., W zależności od miejsca modyfikacji (ryc. 1). Jako ważny sposób na zmianę głównej struktury łańcucha lub grupy łańcucha bocznego łańcuchów peptydowych, modyfikacja peptydów może skutecznie zmienić właściwości fizyczne i chemiczne związków peptydowych, zwiększyć rozpuszczalność wody, przedłużenie czasu działania in vivo, wprowadzenie ich rozkładu biologicznego, eliminacja immunogenności, zmniejszenie toksycznych skutków ubocznych itp.
1. Cyklizacja
Cykliczne peptydy mają wiele zastosowań w biomedycynie, a wiele naturalnych peptydów o aktywności biologicznej to cykliczne peptydy. Ponieważ cykliczne peptydy są zwykle bardziej sztywne niż peptydy liniowe, są wyjątkowo odporne na układ trawienny, mogą przetrwać w przewodzie pokarmowym i wykazywać silniejsze powinowactwo do receptorów docelowych. Cyklizacja jest najbardziej bezpośrednim sposobem syntezy cyklicznych peptydów, szczególnie w przypadku peptydów o dużym szkielecie strukturalnym. Zgodnie z trybem cyklizacji można go podzielić na typ łańcucha łańcucha bocznego, terminal - typ łańcucha bocznego, terminal - typ termina (typ końca do końca).
(1) Sidechain-to-Beidechain
Najczęstszym rodzajem łańcucha bocznego do łańcucha bocznego jest mostkowanie disiarczkowe między resztami cysteiny. Ta cyklizacja jest wprowadzana przez parę reszt cysteinowych, a następnie utlenia się w celu utworzenia wiązań disiarczkowych. Policykliczną syntezę można osiągnąć poprzez selektywne usunięcie grup ochrony sulfhydrylu. Cyklizację można wykonać albo w rozpuszczalniku po dissocjacji lub na żywicy przed dissocjacją. Cyklizacja żywic może być mniej skuteczna niż cyklizacja rozpuszczalnika, ponieważ peptydy na żywicach nie tworzą łatwo cyklifikowanych konformacji. Innym rodzajem cyklizacji łańcucha bocznego - łańcucha bocznego jest tworzenie struktury amidowej między resztą kwasu asparaginowego lub kwasu glutaminowego a aminokwasem podstawowym, co wymaga, aby grupa ochrony łańcucha bocznego musiała być selektywnie usuwana z polipeptydu na żywicy lub po dysocjacji. Trzeci typ cyklizacji łańcucha bocznego jest tworzenie eterów difenylowych przez tyrozynę lub p-hydroksyfenyloglicynę. Ten rodzaj cyklizacji w produktach naturalnych występuje tylko w produktach drobnoustrojów, a produkty cyklizacyjne często mają potencjalną wartość leczniczą. Przygotowanie tych związków wymaga unikalnych warunków reakcji, więc nie są one często stosowane w syntezie konwencjonalnych peptydów.

(2) Terminal-to-Beidechain
Cyklizacja łańcucha po stronie końcowej zwykle obejmuje C-końcowe z grupą aminową lizyny lub łańcucha bocznego ornityny lub N-końcowego z łańcuchem bocznym kwasu asparaginowego lub kwasu glutaminowego. Inna cyklizacja polipeptydowa jest tworzona przez utworzenie wiązań eterowych między końcowymi C i łańcuchami bocznymi seryny lub treoniny.
(3) Typ terminalu lub do ogona
Polipeptydy łańcuchowe można albo jeździć na rozpuszczalniku, albo przymocowane na żywicy przez cyklowanie łańcucha bocznego. Niskie stężenia peptydów należy stosować w centralizacji rozpuszczalnika, aby uniknąć oligomeryzacji peptydów. Wydajność syntetycznego polipeptydu pierścienia z głową do ogona zależy od sekwencji polipeptydu łańcuchowego. Dlatego przed przygotowaniem cyklicznych peptydów na dużą skalę należy najpierw utworzyć bibliotekę możliwych peptydów ołowiowych, a następnie cyklizację, aby znaleźć sekwencję z najlepszymi wynikami.
2. N-metylacja
N-metylacja pierwotnie występuje w naturalnych peptydach i jest wprowadzana do syntezy peptydów, aby zapobiec tworzeniu wiązań wodorowych, dzięki czemu peptydy są bardziej odporne na biodegradację i prześwit. Najważniejszą metodą jest synteza peptydów przy użyciu N-metylowanych pochodnych aminokwasów. Ponadto można również zastosować reakcję Mitsunobu n- (2-nitrobenzen sulfonylu chlorku) polipeptydowo-resena z metanolem. Ta metoda została zastosowana do przygotowania cyklicznych bibliotek peptydowych zawierających N-metylowane aminokwasy.
3. Fosforylacja
Fosforylacja jest jedną z najczęstszych modyfikacji potranslacyjnych w naturze. W ludzkich komórkach ponad 30% białek jest fosforylowanych. Fosforylacja, szczególnie odwracalna fosforylacja, odgrywa ważną rolę w kontrolowaniu wielu procesów komórkowych, takich jak transdukcja sygnału, ekspresja genów, regulacja cyklu komórkowego i cytoszkieletu oraz apoptoza.
Fosforylację można zaobserwować na różnych resztach aminokwasowych, ale najczęstszymi celami fosforylacji są reszty seryny, treoniny i tyrozyny. Pochodne fosfotyrozyny, fosfotreoniny i fosfoseriny można albo wprowadzić do peptydów podczas syntezy, albo utworzone po syntezy peptydu. Selektywną fosforylację można osiągnąć przy użyciu reszt seryny, treoniny i tyrozyny, które selektywnie usuwają grupy ochronne. Niektóre odczynniki fosforylacji mogą również wprowadzać grupy kwasu fosforowego do polipeptydu przez modyfikację. W ostatnich latach specyficzna dla miejsca fosforylacja lizyny została osiągnięta przy użyciu chemicznie selektywnej reakcji fosforytu Staudingera (ryc. 3).

4. Myristoilation and Palmitoilation
Acylacja N-końcowa kwasami tłuszczowymi pozwala peptydom lub białkom wiązać się z błonami komórkowymi. Myridamoilowana sekwencja N-końcowej umożliwia celowanie kinazy białkowej rodziny SRC i odwrotnej transkryptazy GAQ, aby wiązać się z błonami komórkowymi. Kwas mirystyczny był powiązany z N-końcowym wśród żywicy-polipeptydu przy użyciu standardowych reakcji sprzęgania, a powstały lipopeptyd można było zdjąć w standardowych warunkach i oczyszczono przez RP-HPLC.
5. Glikozylacja
Glikopeptydy, takie jak wankomycyna i tekolanina, są ważnymi antybiotykami do leczenia opornych na leki infekcji bakteryjnych, a inne glikopeptydy są często stosowane do stymulowania układu odpornościowego. Ponadto, ponieważ wiele antygenów drobnoustrojowych jest glikozylowanych, ma duże znaczenie dla badania glikopeptydów w celu poprawy działań terapeutycznych zakażenia. Z drugiej strony stwierdzono, że białka na błonie komórkowej komórek nowotworowych wykazują nieprawidłową glikozylację, która sprawia, że glikopeptydy odgrywają ważną rolę w badaniach nad obroną raka i nowotworów. Glikopeptydy przygotowuje się metodą FMOC/T-BU. Glikozylowane reszty, takie jak treonina i seryna, są często wprowadzane do polipeptydów przez FMOC aktywowane estrem pentafluorofenolu w celu ochrony glikozylowanych aminokwasów.
6. Izopren
Izopentadenylacja występuje na resztach cysteiny w łańcuchu bocznym w pobliżu C-końcowym. Izopren białka może poprawić powinowactwo błony komórkowej i tworzyć interakcję białko-białko. Białka izopentadenacyjne obejmują fosfatazę tyrozynową, małą GTazę, cząsteczki kochaperonu, blaszkę jądrową i białka wiążące centromeryczne. Polipeptydy izoprenu można przygotować przy użyciu izoprenu na żywicach lub poprzez wprowadzenie pochodnych cysteiny.
7. Modyfikacja glikolu polietylenowego (PEG)
Modyfikację PEG można zastosować w celu poprawy stabilności hydrolitycznej białka, biodystrybucji i rozpuszczalności peptydowej. Wprowadzenie łańcuchów PEG do peptydów może poprawić ich właściwości farmakologiczne, a także hamować hydrolizę peptydów przez enzymy proteolityczne. Peptydy PEG przechodzą przez kłębuszkowy przekrój naczyń włosowatych łatwiej niż zwykłe peptydy, znacznie zmniejszając klirens nerkowy. Ze względu na przedłużony aktywny okres półtrwania peptydów PEG in vivo normalny poziom leczenia można utrzymać z niższymi dawkami i rzadszymi lekami peptydowymi. Jednak modyfikacja PEG ma również negatywne skutki. Duże ilości PEG zapobiegają degradowaniu peptydu, a także zmniejsza wiązanie peptydu z docelowym receptorem. Ale niskie powinowactwo peptydów PEG jest zwykle kompensowane ich dłuższym farmakokinetycznym okresem półtrwania, a przez dłuższe obecne w ciele peptydy PEG mają większe prawdopodobieństwo wchłonięcia w tkanki docelowe. Dlatego specyfikacje polimerów PEG należy zoptymalizować pod kątem optymalnych wyników. Z drugiej strony peptydy PEG gromadzą się w wątrobie z powodu zmniejszonej klirensu nerek, co powoduje zespół makrocząsteczkowy. Dlatego modyfikacje PEG należy dokładnie zaprojektować, gdy peptydy są stosowane do testowania narkotyków.

Wspólne grupy modyfikacji modyfikatorów PEG można z grubsza podsumować w następujący sposób: amino (-amina) -NH2, aminometylo -ch2 -nh2, hydroksy -oh, karboksy -cooh, sulfhydryl (-thiol) -Sh, maleimid -mal, sularymid węglan -sc, sustniimid -sscm, sulfhydryl (-thiol) -Sh, maleimid -mal, N-hydroxysuccynimid -NHS, akrylan-ch2ch2Cooh, aldehyd -cho (takie jak proponent -ald, butyrald), akrylowa (-akrylan-akryl), azydo-azyd, biotynylo-biotyna, fluoresceina, glutarylowa -ga, akrylate, alkyne-alkyn, P -toluenesulfonian -ts, bursztynian sukcynymidu itp. Pochodne PEG z kwasami karboksylowymi można sprzężyć z aminami N -końcowymi lub łańcuchami bocznymi lizyny. PEG aktywowane amino można sprzężyć z łańcuchami bocznymi kwasu asparaginowego lub kwasu glutaminowego. PEG aktywowane MAL można sprzężyć z Mercaptanem w pełni zepsutych łańcuchów bocznych cysteiny [11]. Modyfikatory PEG są powszechnie klasyfikowane w następujący sposób (Uwaga: MPEG to metoksy-peg, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Modyfikator PEG prosto
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-BALD, MPEG-BUTYRALD, MPEG-SS
(2) Dwutyczne modyfikator PEG
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCl · NH2-PEG-COOH, MAL-PEG-NHS
(3) rozgałęziony modyfikator PEG
(MPEG) 2-NHS, (MPEG) 2-LAD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotynizacja
Biotyna może być silnie związana z awidyną lub streptawidyną, a siła wiązania jest nawet zbliżona do wiązania kowalencyjnego. Peptydy znakowane biotyną są powszechnie stosowane w testowi immunologicznym, histocytochemii i cytometrii przepływowej na bazie fluorescencji. Znakowane przeciwciała antybiotyny można również zastosować do wiązania biotynylowanych peptydów. Etykiety biotyny są często przymocowane do łańcucha bocznego lizyny lub terminala N. Kwas 6-aminokaproinowy jest często stosowany jako wiązanie między peptydami i biotyną. Wiązanie jest elastyczne w wiązaniu z substratem i wiąże się lepiej w obecności przeszkód sterycznych.
9. Etykietowanie fluorescencyjne
Znakowanie fluorescencyjne można stosować do śledzenia polipeptydów w żywych komórkach oraz do badania enzymów i mechanizmów działania. Tryptofan (TRP) jest fluorescencyjny, dzięki czemu można go stosować do znakowania wewnętrznego. Widmo emisji tryptofanu zależy od środowiska obwodowego i zmniejsza się wraz ze spadkiem polaryzacji rozpuszczalnika, właściwości, która jest przydatna do wykrywania struktury peptydu i wiązania receptora. Fluorescencja tryptofanu może być wygaszona przez protonowany kwas asparaginowy i kwas glutaminowy, co może ograniczyć jego zastosowanie. Grupa chlorków dansylowych (dansyl) jest wysoce fluorescencyjna, gdy jest związana z grupą aminową i jest często stosowana jako fluorescencyjna etykieta aminokwasów lub białek.
Konwersja energii rezonansu fluorescencyjnego (FRET) jest przydatna do badań enzymatycznych. Po zastosowaniu FRET polipeptyd substratu zwykle zawiera grupę znakowania fluorescencji i grupę fluorescencyjną. Znakowane grupy fluorescencyjne są gaszone przez wygaszacz poprzez niefotonowe transfer energii. Gdy peptyd jest zdysocjowany z danego enzymu, grupa znakująca emituje fluorescencję.
10. Polipeptydy klatki
Peptydy klatki mają optycznie zdejmowane grupy ochronne, które chronią peptyd przed wiązaniem z receptorem. Po wystawieniu na promieniowanie UV peptyd jest aktywowany, przywracając jego powinowactwo do receptora. Ponieważ tę aktywację optyczną można kontrolować według czasu, amplitudy lub lokalizacji, peptydy klatki można zastosować do badania reakcji występujących w komórkach. Najczęściej stosowanymi grupami ochronnymi dla polipeptydów w klatce są grupy 2-nitrobenzylowe i ich pochodne, które można wprowadzić w syntezie peptydów za pomocą ochronnych pochodnych aminokwasów. Opracowane pochodne aminokwasowe są lizyny, cysteiny, seryny i tyrozyny. Jednak pochodne asparaginianowe i glutaminianowe nie są powszechnie stosowane ze względu na ich podatność na cyklizację podczas syntezy peptydu i dysocjacji.
11. Peptyd policjantyczny (MAP)
Krótkie peptydy zwykle nie są odporne i muszą być sprzężone z białkami nośnymi w celu wytwarzania przeciwciał. Peptyd poliantigenowy (MAP) składa się z wielu identycznych peptydów związanych z jąderami lizyny, które mogą wyraźnie wyrażać immunogeny o dużej mocy i mogą być stosowane do przygotowania kupletów białkowych z peptydem. Polipeptydy MAP można zsyntetyzować za pomocą syntezy fazy stałej na żywicy MAP. Jednak niepełne sprzężenie powoduje brakujące lub skrócone łańcuchy peptydowe na niektórych gałęziach, a zatem nie wykazuje właściwości oryginalnego polipeptydu map. Jako alternatywę peptydy można przygotować i oczyszczać osobno, a następnie sprzężenie z mapą. Sekwencja peptydowa przyłączona do rdzenia peptydu jest dobrze zdefiniowana i łatwo scharakteryzowana przez spektrometrię mas.
Wniosek
Modyfikacja peptydów jest ważnym sposobem projektowania peptydów. Chemicznie zmodyfikowane peptydy mogą nie tylko utrzymać wysoką aktywność biologiczną, ale także skutecznie unikać wad immunogenności i toksyczności. Jednocześnie modyfikacja chemiczna może wyposażać peptydy o nowych doskonałych właściwościach. W ostatnich latach szybko opracowano metodę aktywacji C-H do postmodyfikacji polipeptydów i osiągnięto wiele ważnych wyników.
Czas postu: 2025-07-03
