W branży biomedycznej leki peptydowe przyciągnęły dużą uwagę ze względu na ich wysoką wydajność i niskie skutki uboczne. Jednak złożoność struktury polipeptydowej jest niezbędna do pełnego zrozumienia jej właściwości i funkcji. Jako potężne narzędzie, usieciowana spektrometria masowa zapewniła nam nieocenioną pomoc w rozwiązaniu tajemnicy struktury peptydowej w złożonych próbkach. Ten artykuł szczegółowo wprowadzi technikę spektrometrii masowej, od zasady do zastosowania, i zabierze Cię w to fascynującą dziedzinę nauki.
1. Podstawowe zasady usieciowanej spektrometrii mas:
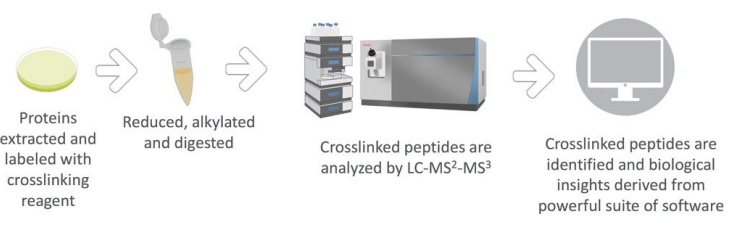
Spektrometria masowa usieciowana jest ważnym wsparciem dla spektrometrii masowej, która służy głównie do badania struktury i interakcji peptydów białkowych. Podstawową zasadą jest „powiązanie” różnych regionów funkcjonalnych w białku lub peptydu przez sieciownik z utworzeniem usieciowanego związku. Te połączone związki zostały następnie analizowane i przetestowane za pomocą spektrometru masowego.
2. Proces działania testu:
A. Wybór łącznika: wybór odpowiedniego łącznika jest szczególnie ważny dla pomyślnego procesu. Wspólne łączniki obejmują krzemionkę, formaldehyd itp.
B. Reakcja sieciowania: próbka reaguje się na środek sieciujący w celu promowania sieciowania między peptydami.
C. Trawienie enzymatyczne: W celu dalszej poprawy dokładności spektrometrii mas, połączone związki muszą być trawione enzymatycznie i przekształcić w mniejsze fragmenty.
D. Spektrometria mas: enzymatyczne hydrolizowane próbki wstrzyknięto do spektrometru masowego i informacje strukturalne związków usieciowanych uzyskano za pomocą spektrometrii mas.
W jaki sposób można zastosować usieciowaną spektrometrię mas do analizy struktury peptydów w złożonych próbkach?
3. Zastosowanie spektrometrii masowej w sieci w analizie struktury peptydu:
A. Badania struktury leków peptydowych: Spektrometria masowa usieciowana stanowi wiarygodną metodę badania precyzyjnej struktury leków peptydowych. Porównując widma masowe związków usieciowanych, naukowcy mogą określić sposób powiązania między różnymi resztami aminokwasowymi w peptydzie, a następnie ujawnić przestrzenną strukturę peptydu.
B. Analiza kompleksu białek: wiele procesów biologicznych obejmuje interakcję między białkami i innymi biomolekułami. Spektrometria masowa usieciowana może pomóc nam zrozumieć skład i strukturę kompleksów białkowych, a następnie dalej badać ich funkcje i mechanizmy kontrolne.
C. Badania identyfikacji choroby: niektóre choroby powodują patologiczną ekspresję lub zmiany strukturalne określonych peptydów. Spektrometria masowa usieciowana może pomóc zidentyfikować te zmiany i zapewnić nowe wskazówki dotyczące diagnozy i leczenia chorób.
4. Wyzwania i przyszłe perspektywy usieciowanej spektrometrii mas:
Chociaż usieciowana spektrometria mas ma ogromny potencjał do analizy struktury peptydów, nadal stoi w obliczu kilku wyzwań. Kwestie takie jak złożoność próbki i interpretacja analizy spektrometrii mas do wyboru łączycieli krzyżowych są stale ulepszane i udoskonalane. W przyszłości możemy spodziewać się większych przełomów w rozdzielczości, wrażliwości i automatyzacji usieciowanej spektrometrii mas, aby zapewnić silne wsparcie dla szerszego zakresu badań biomedycznych.
5. Wyniki
Jako ważne narzędzie w dziedzinie biomedycznej, usieciowana spektrometria mas zapewnia ważną informację do analizy struktur peptydowych w złożonych próbkach. Rozumiejąc uzasadnienie i eksperymentalne działanie spektrometrii masowej, możemy lepiej zrozumieć jej zastosowanie w opracowywaniu leków peptydowych, interakcji białek i badaniach markerów chorobowych. Wraz z ciągłym rozwojem technologii, usieciowana spektrometria masowa będzie nadal odgrywać ważną rolę w przemyśle biomedycznym, promując postęp i innowacje w naukach farmaceutycznych.
Czas postu: 2025-07-01