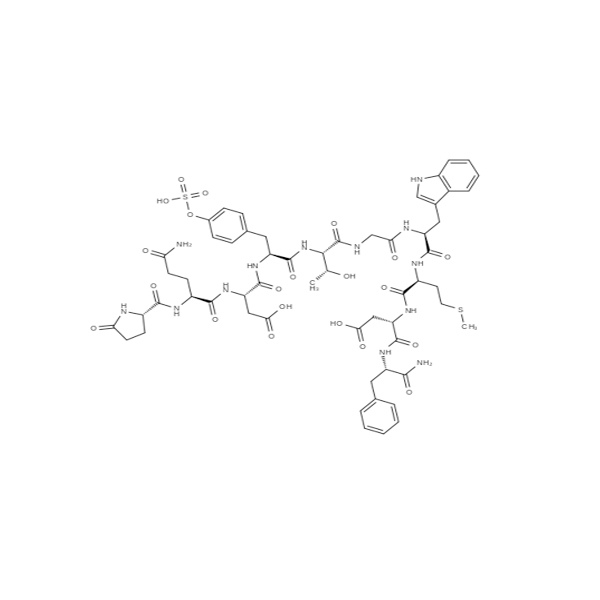
CecropinP1/125667-96-1/GT Peptyd/Dostawca peptydów
Opis
Cekropina P1,świńskito peptyd farmaceutyczny, który jest również peptydem przeciwdrobnoustrojowym, pierwotnie występującym u ćmy Hyalophora cecropia, a później w jelicie świni.Wygląd to biały proszek, warunki przechowywania muszą być zgodne ze szczegółowymi instrukcjami produktu
Dane techniczne
Wygląd: Proszek od białego do prawie białego
Czystość (HPLC):≥98,0%
Pojedyncze zanieczyszczenie:≤2,0%
Zawartość octanu (HPLC): 5,0%~12,0%
Zawartość wody (Karla Fischera):≤10,0%
Zawartość peptydu:≥80,0%
Pakowanie i wysyłka: Niska temperatura, pakowanie próżniowe, z dokładnością do mg, zgodnie z wymaganiami.
Jak zamówić?
1. Contact us directly by phone or email: +86-13735575465, sales1@gotopbio.com.
2. Zamów online.Prosimy o wypełnienie formularza zamówienia online.
3. Podaj nazwę peptydu, numer CAS lub sekwencję, czystość i modyfikację, jeśli jest to wymagane, ilość itp. Wycenę prześlemy w ciągu 2 godzin.
4. Potwierdzenie zamówienia poprzez należycie podpisaną umowę sprzedaży i umowę NDA (umowa o zachowaniu poufności) lub umowę poufną.
5. Będziemy na bieżąco aktualizować postęp zamówienia.
6. Dostawa peptydów firmami DHL, Fedex lub innymi oraz HPLC, MS, COA będzie zapewniona wraz z ładunkiem.
7. W przypadku jakichkolwiek rozbieżności w jakości lub usługach będziemy przestrzegać polityki zwrotów.
8. Obsługa posprzedażna: Jeśli nasi klienci mają jakiekolwiek pytania dotyczące naszego peptydu podczas eksperymentu, prosimy o kontakt, a my odpowiemy na nie w krótkim czasie.
Wszystkie produkty firmy są wykorzystywane wyłącznie do celów badań naukowych, tj'Zabrania się bezpośredniego stosowania przez jakiekolwiek osoby na ciele ludzkim.
Często zadawane pytania:
Czy przed wysyłką zmniejszono ilość peptydów zawierających Cys?
Jeżeli nie stwierdzono, że peptyd został utleniony, zazwyczaj nie redukujemy Cys.Wszystkie polipeptydy otrzymywane są z surowych produktów oczyszczonych i liofilizowanych w warunkach pH2, które przynajmniej w pewnym stopniu zapobiegają utlenianiu Cys.Peptydy zawierające Cys oczyszcza się przy pH 2, chyba że istnieje konkretny powód, aby oczyszczać przy pH 6,8.Jeśli oczyszczanie przeprowadza się przy pH 6,8, oczyszczony produkt należy natychmiast potraktować kwasem, aby zapobiec utlenianiu.W końcowym etapie kontroli jakości, w przypadku peptydów zawierających Cys, jeśli na mapie MS zostanie stwierdzona obecność substancji o masie cząsteczkowej (2P+H), oznacza to, że powstał dimer.Jeśli nie ma problemu z MS i HPLC, bezpośrednio liofilizujemy i wysyłamy towar bez dalszej obróbki.Należy zauważyć, że peptydy zawierające Cys z biegiem czasu ulegają powolnemu utlenianiu, a stopień utlenienia zależy od sekwencji peptydów i warunków przechowywania.
Jak określić, czy peptyd jest zapętlony?
Używamy reakcji Ellmana, aby sprawdzić, czy tworzenie pierścienia zostało zakończone.Jeśli test Ellmana jest dodatni (żółty), reakcja pierścieniowa jest niekompletna.Jeśli wyniki testu są negatywne (nie żółte), reakcja pierścieniowa została zakończona.Nie udostępniamy naszym klientom raportu z analizy identyfikacji cyklizacji.Ogólnie rzecz biorąc, raport kontroli jakości będzie zawierał opis wyników testu Ellmana.
Potrzebuję cyklicznego peptydu, który zawiera tryptofan, czy zostanie utleniony?
Utlenianie tryptofanu jest powszechnym zjawiskiem podczas utleniania peptydów, a peptydy zwykle poddaje się cyklizacji przed oczyszczeniem.Jeśli nastąpi utlenianie tryptofanu, czas retencji peptydu na kolumnie HPLC ulegnie zmianie i utlenianie można usunąć poprzez oczyszczenie.Ponadto utlenione peptydy można również wykryć metodą MS.
Czy konieczne jest utworzenie szczeliny pomiędzy peptydem a barwnikiem?
Jeśli zamierzasz przyłączyć dużą cząsteczkę (taką jak barwnik) do peptydu, najlepiej jest umieścić odstęp pomiędzy peptydem a ligandem, aby zminimalizować interferencję z receptorem przez zwijanie samego peptydu lub przez zwijanie jego koniugat.Inni nie chcą przerw.Na przykład podczas zwijania białek można określić, jak daleko od siebie znajduje się zwijana struktura aminokwasu, poprzez przyłączenie barwnika fluorescencyjnego do określonego miejsca.
Jeśli chcesz dokonać modyfikacji biotyny na końcu N, czy musisz umieścić przerwę między biotyną a sekwencją peptydu?
Standardowa procedura znakowania biotyną stosowana przez naszą firmę polega na dołączeniu Ahx do łańcucha peptydowego, a następnie biotyny.Ahx to związek 6-węglowy, który działa jako bariera pomiędzy peptydem a biotyną.
Czy możesz udzielić porady na temat projektowania fosforylowanych peptydów?
Wraz ze wzrostem długości skuteczność wiązania stopniowo maleje, zaczynając od fosforylowanego aminokwasu.Kierunek syntezy przebiega od końca C do końca N.Zaleca się, aby reszty po fosforylowanym aminokwasie nie przekraczały 10, to znaczy liczba reszt aminokwasowych przed fosforylowanym aminokwasem od końca N do końca C nie powinna przekraczać 10.
Dlaczego n-końcowa acetylacja i C-końcowa amidacja?
Modyfikacje te zapobiegają degradacji peptydu i umożliwiają peptydowi naśladowanie jego pierwotnego stanu grup alfa aminowych i karboksylowych w białku macierzystym.